Das übergreifende Ziel unserer Forschung ist es, herauszufinden, wie Stoffwechsel und Signalübertragung in B-Zellen im normalen und im kranken Zustand verbunden sind. B-Zellen spielen eine entscheidende Rolle bei der Abwehr von Krankheitserregern. Eine verringerte B-Zell-Aktivität kann daher zu einer erhöhten Anfälligkeit für Infektionen führen. Andererseits können abnorm aktivierte B-Zellen zur Entwicklung verschiedener Autoimmunerkrankungen beitragen oder zu Krebszellen werden.
In der Vergangenheit hat sich die Forschung vor allem darauf konzentriert zu verstehen, wie proteinbasierte Signalnetzwerke das Schicksal und die Funktion von B-Zellen steuern. In den letzten Jahren hat sich jedoch die Ansicht durchgesetzt, dass das metabolische Programm von Immunzellen nicht einfach ein Nebenprodukt der Zellaktivierung ist, sondern eng mit der proteinbasierten Signalübertragung verwoben ist und die Entscheidungen über das Zellschicksal aktiv steuert. Unser Ziel ist es, herauszufinden, wie verschiedene Signalwege den B-Zell-Stoffwechsel beeinflussen, wie B-Zellen mit metabolischem Stress umgehen und wie die metabolische Mikroumgebung die Signaltransduktion beeinflusst. Wir haben gezeigt, dass eine abnorm erhöhte Stoffwechselaktivität die B-Zellproliferation ankurbeln oder die B-Zellen anfälliger für Apoptose machen kann. Die Wahl zwischen diesen beiden funktionell gegensätzlichen Resultaten hängt vom Signalkontext, dem Entwicklungsstatus und der Mikroumgebung der Zellen ab. Außerdem haben wir gezeigt, dass die Produktion von Immunglobulinen die metabolische Flexibilität beeinflussen kann, indem sie die Homöostase des endoplasmatischen Retikulums steuert. Wir haben herausgefunden, dass diese Funktion der Immunglobuline unabhängig von ihrer Rolle als Zellmembranrezeptoren ist, und haben damit eine neue Art der Stoffwechselregulation in B-Zellen identifiziert.
Zusammenfassend unterstreichen unsere Studien die Bedeutung, die Stoffwechselprozesse bei der Steuerung von B-Zell-Reaktionen spielen. Da Krebszellen erhöhte Anforderungen an den Stoffwechsel stellen und häufig einer feindlichen Umgebung ausgesetzt sind, könnte ein besseres Verständnis der Regulierung des Zellstoffwechsels dazu beitragen, neue Schwachstellen in bösartigen B-Zellen zu erkennen und die Entwicklung neuer Behandlungsstrategien zu fördern.











Julia Jellusova studierte Biologie und promovierte an der Friedrich-Alexander-Universität Erlangen-Nürnberg. Sie schloss ihre Doktorarbeit zum Thema: "Regulation von B1-Zellen und systemischer Autoimmunität in Mäusen durch Siglec-G" im Jahr 2010 mit "summa cum laude" ab. Zwischen 2010 und 2015 arbeitete sie als Postdoc am Sanford Burnham Prebys Medical Discovery Institute in La Jolla, USA. Ende 2015 wechselte sie als Nachwuchsgruppenleiterin an die Albert-Ludwigs-Universität Freiburg, wo sie mit Unterstützung eines Margarete von Wrangell-Stipendiums an ihrer Habilitation arbeitete. Im Jahr 2021 wurde sie als Tenure-Track-Professorin an die Technische Universität München berufen. Ihre Forschung ist auf Signaltransduktion und Zellstoffwechsel von B-Lymphozyten fokusiert. 2023 wurde sie Sprecherin der DFG Forschergruppe „Wechselwirkungen zwischen dem Stoffwechsel und der Signalübertragung in B-Zellen“.
Weitere Informationen zum Labor Jellusova finden Sie auf der Seite des Zentralinstituts für Translationale Krebsforschung (TranslaTUM)
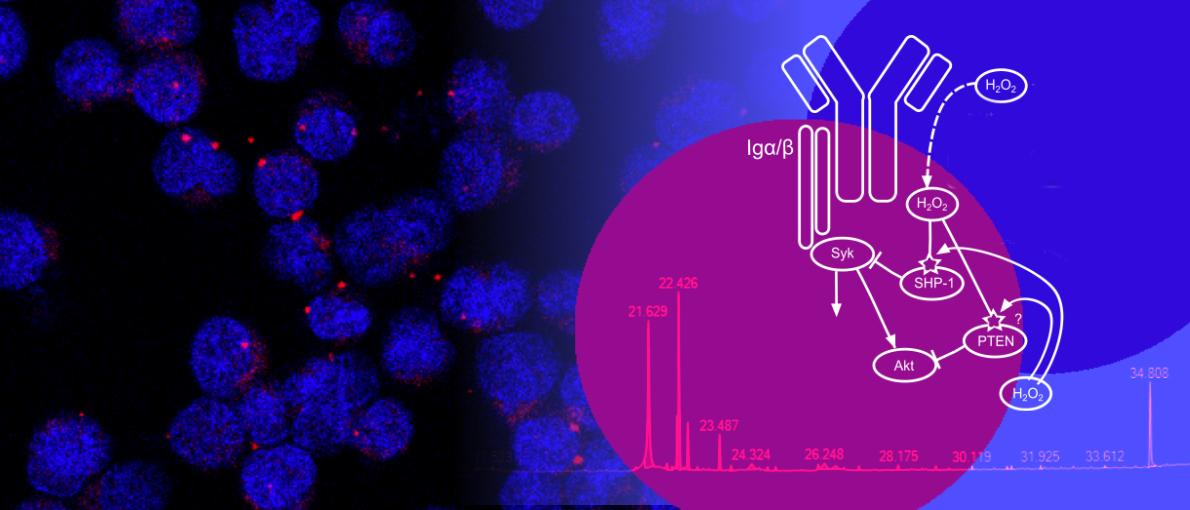
CD20 as a gatekeeper of the resting state of human B cells.
Kläsener, K., Jellusova, J., Andrieux, G., Salzer, U., Böhler, C., Steiner, S.N., Albinus, J.B., Cavallari, M., Süß, B., Voll, R.E., Boerries, M., Wollscheid, B., Reth, M. (2021). Proc. Natl. Acad. Sci. U. S. A. 118, 1–10. doi 10.1073/pnas.2021342118
Immunoglobulin expression in the endoplasmic reticulum shapes the metabolic fitness of B lymphocytes.
Jumaa, H., Caganova, M., McAllister, E.J., Hoenig, L., He, X., Saltukoglu, D., Brenker, K., Köhler, M., Leben, R., Hauser, A.E., Niesner, R., Rajewsky, K., Reth, M., Jellusova, J. (2020). Life Sci. Alliance 3, 1–17. doi 10.26508/lsa.202000700
Metabolic control of B cell immune responses.
Jellusova, J. (2020). Curr. Opin. Immunol. 63, 21–28. (Review). doi 10.1016/j.coi.2019.11.002
New Methods To Analyze B Cell Immune Responses to Thymus-Dependent Antigen Sheep Red Blood Cells.
McAllister, E.J., Apgar, J.R., Leung, C.R., Rickert, R.C., and Jellusova, J. (2017). J. Immunol. 199, 2998–3003. doi 10.4049/jimmunol.1700454
Gsk3 is a metabolic checkpoint regulator in B cells.
Jellusova, J., Cato, M.H., Apgar, J.R., Ramezani-Rad, P., Leung, C.R., Chen, C., Richardson, A.D., Conner, E.M., Benschop, R.J., Woodgett, J.R., et al. (2017). Nat. Immunol. 18, 303–312. doi 10.1038/ni.3664
Essential Role for Survivin in the Proliferative Expansion of Progenitor and Mature B Cells.
Miletic, A. V.*, Jellusova, J.*, Cato, M.H., Lee, C.R., Baracho, G. V., Conway, E.M., and Rickert, R.C. (2016). J. Immunol. 196, 2195–2204.* equal contribution. doi 10.4049/jimmunol.1501690
Context-Specific BAFF-R Signaling by the NF-κB and PI3K Pathways.
Jellusova, J. *, Miletic, A. V.*, Cato, M.H., Lin, W.W., Hu, Y., Bishop, G.A., Shlomchik, M.J., and Rickert, R.C. (2013). Cell Rep. 5, 1022–1035. * equal contribution. doi 10.1016/j.celrep.2013.10.022
Requirement for Rictor in homeostasis & function of mature B lymphoid cells.
Lee, K., Heffington, L., Jellusova, J., Nam, K.T., Raybuck, A., Cho, S.H., Thomas, J.W., Rickert, R.C., and Boothby, M. (2013). Blood 122, 2369–2379. doi 10.1182/blood-2013-01-477505
Siglec-G Regulates B1 Cell Survival and Selection.
Jellusova, J., Düber, S., Gückel, E., Binder, C.J., Weiss, S., Voll, R., and Nitschke, L. (2010b). J. Immunol. doi 10.4049/jimmunol.1001792
CD22 x Siglec-G double-deficient mice have massively increased B1 cell numbers and develop systemic autoimmunity.
Jellusova, J., Wellmann, U., Amann, K., Winkler, T.H., and Nitschke, L. (2010a). J. Immunol. 184, 3618–3627. doi 10.4049/jimmunol.0902711


